М > МО
Моносахариды
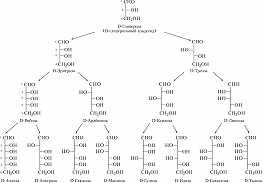
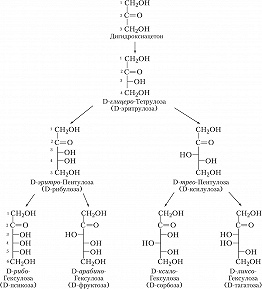
Моносахариды. Рис. 1. Альдозы D- ряда. Моносахариды. Рис. 2. Кетозы D- ряда.
МОНОСАХАРИДЫ
Авторы: А.И. УсовМОНОСАХАРИДЫ, углеводы, представляющие собой полигидроксиальдегиды (альдозы) и полигидроксикетоны (кетозы) общей формулы C n H 2 n O n (n = 3 − 9),. Основу М. составляет неразветвлённая цепочка углеродных атомов, соединённых между собой одинарными связями. Один из атомов углерода связан двойной связью с кислородом (C ═ O, карбонильная группа); ко всем остальным атомам углерода присоединены гидроксильные группы (OH). У альдоз карбонильная группа расположена в начале цепи (C 1), у кетоз - в любом другом положении. М. - бесцветные кристаллич. вещества, легко растворимые в воде и нерастворимые в неполярных органич. растворителях. Исходя из количества атомов углерода в цепи среди М. различают триозы, тетрозы, пентозы, гексозы, гептозы, октозы и нонозы. На рисунках 1 и 2 приведены линейные структурные формулы некоторых М. и даны общепринятые тривиальные названия для каждого соединения. Для М. характерна стереоизомерия. Все М. (кроме дигидроксиацетона) имеют один или неск. асимметричных, или хиральных, атомов углерода и, следовательно, могут встречаться в виде оптически активных изомеров - энантиомеров. Простейшая альдоза - глицериновый альдегид - содержит только один асимметричный центр и таким образом может существовать в виде двух энантиомеров. Для М., имеющих два и более хиральных центров, характерно также наличие диастериомеров, напр. альдогексозы имеют 4 асимметричных центра (могут существовать в виде 16 разл. стереоизомеров). Обозначения «D» и «L» указывают на конфигурацию асимметричного атома углерода, максимально удалённого от атома углерода карбонильной группы (см. Изомерия). Два М., различающихся по конфигурации вокруг только одного атома углерода, представляют собой эпимеры по отношению друг к другу (напр., D-глюкоза и D-манноза, D-глюкоза и D-галактоза). М., скелет которых состоит из 5 и более атомов углерода, в растворах существуют в виде устойчивых циклич. структур; при этом карбонильная группа образует ковалентную связь с одной из гидроксильных групп, связанных с атомом углерода осн. цепи (образуется полуацеталь). Такие циклич. формы гексоз из-за их сходства с циклич. соединением пираном получили назв. пираноз. Т. к. при этом первый (альдегидобразующий) атом углерода становится асимметричным, М. может существовать в виде двух энантиомеров, для обозначения которых используют символы « α » и « β ». В итоге число асимметричных центров в молекуле D-глюкозы, напр., оказывается на один больше по сравнению с тем числом, которое предусматривает линейная формула. Изомерные формы М., отличающиеся конфигурацией полуацетального углеродного атома (такие как α -D-глюкоза и β -D-глюкоза), называются аномерами. Гексозы существуют также в виде менее устойчивых циклич. соединений с пятичленными кольцами. Из-за сходства таких колец с циклич. соединением фураном их называют фуранозами. Кроме карбонильной и гидроксильных групп, в молекулу М. могут входить вместо одной или нескольких гидроксильных групп атомы водорода, аминогруппа (NH 2, аминосахара), тиольная группа (SH, тиосахара), карбоксильная группа (COOH) и др. М. могут обладать разветвлённым скелетом (с метильной, гидроксиметильной или альдегидной группой в качестве ответвлений), двойной углерод-углеродной связью и т. д. Среди наиболее важных производных М. - уроновые кислоты, аминосахара, дезокси сахара, сиаловые кислоты. В природе в свободном виде в значит. количествах широко встречаются только глюкоза и фруктоза. Остальные входят в состав олиго- и полисахаридов, смешанных биополимеров (гликопротеинов, гликолипидов, нуклеиновых кислот и др.). М. и их производные активно участвуют в метаболизме живой клетки. С их превращениями связаны обеспечение клетки энергией, детоксикация и выведение ядовитых веществ, биосинтез аминокислот, сложных биополимеров и др. важных для жизнедеятельности соединений. М. используют гл. обр. в пищевой и мед. пром-сти. В пром. масштабах М. получают кислотным гидролизом полисахаридов: напр., D-глюкозу - из крахмала, D-ксилозу - из отходов переработки с.-х. растений и древесины. Смесь глюкозы с фруктозой получают гидролизом сахарозы. D-Сорбит и ксилит восстанавливают из D-глюкозы и D-ксилозы; D-сорбит служит исходным соединением в синтезе аскорбиновой кислоты и наряду с ксилитом используется как обладающий сладким вкусом заменитель сахарозы.
Литература Лит.: Стоддарт Дж. Стереохимия углеводов. М., 1975; Степаненко Б.Н. Химия и биохимия углеводов: Моносахариды. М., 1977; El Khadem H. S. Carbohydrate chemistry: Monosaccharides and their oligomers. San Diego, 1988.


