И > ИМ
Иммуноглобулин
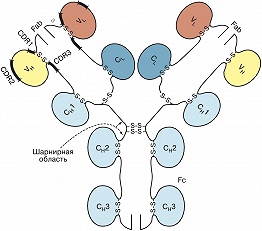
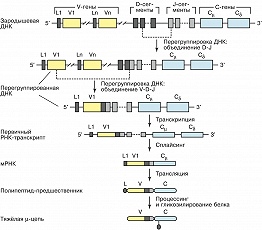
Рис. 1. Строение молекулы IgG1 человека: VH и VL - вариабельные домены соответственно тяжёлой и лёгкой цепей; CL - константный домен лёгкой цепи; СH1, СH2, СH3 - константные домены
Рис. 2. Схема перегруппировки генов и биосинтеза µ-цепи иммуноглобулина.
ИММУНОГЛОБУЛИН
Авторы: С.М. ДеевИММУНОГЛОБУЛИН (Ig), сложный глобулярный белок позвоночных животных (начиная с хрящевых рыб) и человека, обладающий активностью антитела, т. е. способностью специфически взаимодействовать с антигеном (см. Антиген - антитело реакция). И. присутствует либо в свободном виде в крови и др. жидкостях организма, либо в виде рецепторов на поверхности клеточных мембран. У каждого индивидуума существует громадное разнообразие молекул И., различающихся по специфичности. Они синтезируются плазматич. клетками, дифференцировка которых инициируется взаимодействием В-лимфоцитов иммунной системы (имеющих рецептор нужной специфичности) с антигенами при участии ряда медиаторов (напр., интерлейкинов). Уникальная специфичность И. и высокое сродство к «своему» антигену обеспечивается комплементарностью активного центра И. к участку молекулы антигена (эпитопу). Одновременно И. могут связываться с рецепторами лейкоцитов (т. н. Fc-рецепторами) или белками системы комплемента, в результате чего включается цепь последовательных реакций иммунной системы организма, приводящих к удалению чужеродного агента (защитная функция иммуноглобулина).
Классы иммуноглобулинов
У человека известно 5 классов И.: IgM, IgD, IgG, IgE и IgA. Как при дифференцировке В-лимфоцитов, так и в ходе первичного иммунного ответа первыми синтезируются IgM; они эффективно связывают комплемент, служат основными рецепторами антигенов на поверхности зрелых В-лимфоцитов, где присутствуют в виде мономеров; в сыворотке крови находятся в форме пентамеров (включают 5 мономеров, соединённых J-цепями). IgD в следовых количествах присутствуют в сыворотке крови здоровых людей; выполняют функцию мембранных рецепторов на поверхности В- лимфоцитов. IgG доминируют в сыворотке млекопитающих (более 75% от общегоколичества И.) и составляют основу вторичного (развивающегося при повторной встрече с тем же антигеном) иммунного ответа. Они способны проникать через плаценту, обеспечивая иммунную защиту плода. IgG подразделяются на 4 подкласса - IgG1, IgG2, IgG3, IgG4, доля каждого из которых в сыворотке убывает в указанном ряду. Большинство подклассов (IgG1, IgG2, IgG3) способно активировать комплемент. Все подклассы связываются с Fc-рецепторами полиморфно-ядерных лейкоцитов, а IgG1 и IgG3 - также и с Fc-рецепторами моноцитов. IgE взаимодействует с Fc- рецепторами тучных клеток и базофил; при контакте нескольких связанных с рецепторами молекул IgЕ с антигеном эти клетки начинают секретировать серотонин, гистамин и др. медиаторы, что может явиться причиной аллергич. реакции и анафилактич. шока. IgА защищают слизистые оболочки, а также обеспечивают передачу иммунитета от матери к новорождённому, подразделяются на два подкласса: IgА1, присутствующие в осн. в сыворотке крови, и IgА2, содержащиеся в слюне, пищеварит. соке, молозиве, слизистой оболочке носа.Строение молекулы иммуноглобулинов
И. разных классов имеют структурные и функциональные особенности, но общая организация молекул сохраняется у всех И. У большинства изученных видов организмов мономерная молекула И. построена из 4 полипептидных цепей: двух одинаковых тяжёлых (H) и двух одинаковых лёгких (L). Исключение составляют И. сем. верблюдовых и некоторых видов акул, где б. ч. И. содержит только две тяжёлые цепи. Молекулы И. симметричны и представляют собой гликопротеины с чётко выраженной доменной структурой; домены, состоящие примерно из 110 аминокислотных остатков, гомологичны по первичной структуре и имеют характерную укладку цепи (рис. 1). Все 4 цепи соединены дисульфидными связями, которые имеются и внутри доменов, стабилизируя структуру отд. глобулярных областей. N- концевые домены существенно различаются у разных И. и носят назв. вариабельных (V); V H и V L - вариабель ные домены тяжёлой и лёгкой цепей соответственно. Они формируют антигенсвязывающий центр (Fab, или Fv), причём на каждую мономерную молекулу И. приходится по два таких центра. С-концевая часть каждого полипептида в пределах класса изменяется мало и называется константной (С) областью. Она включает один C L -домен у лёгких цепей и три или четыре (в зависимости от класса) С H -домена у тяжёлых цепей. Вариабельность аминокислотных остатков внутри V- доменов наиболее высока в коротких гипервариабельных областях (CDR1-CDR3), разделённых т. н. каркасными участками, на которые приходится ок. 80% всего V- домена. Каркасные участки поддерживают однотипную трёхмерную структуру V- доменов, необходимую для обеспечения контактов гипервариабельных участков с антигенами. Часть молекулы И., состоящую из С-концевых доменов тяжёлых цепей, обозначают как Fc-фрагмент. Он опосредует связывание белков комплемента, взаимодействие с рецепторами лейкоцитов и соединён с остальной частью молекулы И. гибкой «шарнирной» областью, благодаря чему антигенсвязывающие участки И. обладают определённой пространственной свободой. Различают 5 осн. типов тяжёлых цепей (µ, δ, γ, α и ε), которые содержат 450-600 аминокислотных остатков, и 2 типа лёгких (ϰ и λ), включающих ок. 230 аминокислотных остатков. Лёгкие цепи ϰ и λ могут быть соединены с любым типом тяжёлых цепей иммуноглобулина.Гены иммуноглобулинов
Разнообразие И. обеспечивается строением их генов и перегруппировками ДНК. В геномах человека и мыши имеются три независимых локуса генов И. - ϰ, λ и H. Каждый из них включает набор генов, кодирующих вариабельные домены и единичные гены константных областей, причём эти группы генов находятся на значит. расстоянии друг от друга. Образование лёгкой и тяжёлой цепей происходит в результате рекомбинации одного из вариабельных генов (V) с геном, кодирующим константный участок (С). Перед каждым геном имеется участок ДНК, кодирующий лидерный пептид (L). Между V- и С-генами находятся последовательности (D-сегменты и J-сегменты), кодирующие небольшие фрагменты полипептидной цепи, входящие в вариабельные области. Огромное разнообразие И. достигается в результате: существования большого числа вариабельных областей V-генов в каждом из H-, ϰ - и λ -локусов; рекомбинации между V-генами, D- и J-cегментами, кодирующими фрагменты вариабельных доменов; разнообразия вариантов, возникающих на границе соединяющихся сегментов как следствие неточного соединения, делеции или включения дополнит. нуклеотидов; комбинаций между лёгкими и тяжёлыми цепями. Дополнит. разнообразие И. определяется соматическими точечными мутациями, происходящими в перегруппированных генах. При созревании В-лимфоцитов имеет место перегруппировка ДНК, приводящая к переносу одного из V-генов к одному из J-сегментов (в случае генов тяжёлых цепей предварительно протекает рекомбинация между D- и J-сегментами, рис. 2). В результате такой V(D)J-рекомбинации происходит сближение вариабельных и константных участков, а также регуляторных элементов транскрипции (промоторов и энхансеров). В ходе развития клеток иммунной системы может происходить изменение класса синтезируемого И. Оно обусловливается генетич. процессом, включающим новую перегруппировку ДНК и носящим назв. «переключение изотипа». При этом происходит замена в зрелом гене тяжёлых цепей одного С H -гена другим. Процесс не затрагивает ни V H -генов, ни генов лёгких цепей, и, следовательно, специфичность И., синтезируемых данной клеткой, остаётся неизменной. В некоторых случаях изменение класса синтезируемой тяжёлой цепи достигается за счёт альтернативного сплайсинга.Применение иммуноглобулинов
В 1975 разработан метод, позволяющий получать клеточные линии (гибридомы), секретирующие гомогенную популяцию моноклональных антител. Последние широко используются для целей диагностики и биотехнологии, но применение для терапии ограничивается тем, что с помощью гибридомной технологии удаётся получать молекулы гл. обр. мышиных И., которые вызывают у человека иммунный ответ. Целью нового направления в области иммунологии, названного «инженерия антител», является создание на основе генов И. не существующих в природе структур с заранее заданными свойствами. Получено неск. типов таких антител. В химерных, или гуманизированных, антителах контактирующие с антигеном участки вариабельных доменов (CDR) взяты от мышиных И., а всё остальное, включая каркасные участки V- доменов, - от И. человека; они обладают низкой иммуногенностью и способны адекватно взаимодействовать с иммунной системой человека. Иммуноадгезины состоят из Fc-фрагмента молекулы И. и лиганда, специфичного к определённому рецептору; такая молекула в результате связывания с рецептором на поверхности инфицированных вирусом клеток и за счёт Fc-фрагмента способна вызывать уничтожение инфициров. клеток лейкоцитами посредством антителозависимой цитотоксичности или действия системы комплемента. Мини-антитела, или Fv- фрагменты, представляют собой лишь часть молекулы И., отвечающую за связывание чужеродного антигена (из-за малого размера они легче проникают в патогенную ткань и обладают пониженной иммуногенностью). Рекомбинантные иммунотоксины и иммуноферменты получают в результате экспрессии генов И., соединённых с генами токсинов или ферментов. И. широко используются в медицине для диагностики, профилактики и лечения разл. заболеваний.Литература Лит.: Деев С.М. Иммуноглобулины. Белки иммунной системы. М., 1997; Ройт А., Бростофф Дж., Мейл Д. Иммунология. М., 2000; Mayer G. Immunoglobulins-structure and function // Microbiology and Immunology on-line / http://pathmicro.med.sc.edu.


