Автор: Владимиров Ю.А.
Статей: 1Биолюминесценция



БИОЛЮМИНЕСЦЕНЦИЯ
Авторы: Ю.А. Владимиров, Ю.А. ЛабасБИОЛЮМИНЕСЦЕНЦИЯ (от био… и люминесценция), видимое в темноте свечение живых организмов. В большинстве случаев это свечение обусловлено специфич. ферментативными реакциями. Субстраты реакций, сопровождающихся Б., называются независимо от их химич. природы люциферинами, а участвующие в этих реакциях ферменты - люциферазами. Б. обнаружена более чем у 1000 видов организмов разных уровней организации, в т. ч. у отд. видов бактерий, грибов, простейших, кишечнополостных, моллюсков, ракообразных, насекомых и рыб. Подавляющее большинство способных к Б. организмов - морские. Среди обитателей суши - некоторые грибы, черви, улитки, многоножки и насекомые; очень мало пресноводных видов (пока известна одна новозеландская улитка Latia neritoides, неск. видов паразитич. бактерий). Свечение может испускать вся поверхность тела или спец. свечения органы; чаще всего оно синего или зелёного цвета, реже жёлтого, иногда красного.
Механизмы биолюминесценции
Б. представляет собой частный случай хемилюминесценции: энергия химич. реакции (чаще всего это окисление люциферина молекулярным кислородом или его активными формами - пероксидом водорода или супероксид анион-радикалом O 2) превращается в энергию электронного возбуждения одного из продуктов реакции, которая выделяется в виде фотонов с высоким квантовым выходом (30- 90%). У большинства эукариот светится не всё тело, а особые клетки - фотоциты и в них - отд. органеллы (люмисомы, фотосомы). Такие клетки образуют фотогенную ткань, а у мн. высших беспозвоночных и рыб - особые органы свечения - фотофоры, иногда очень сложно устроенные (внутренняя полость, отражатель, линза). У некоторых рыб и кальмаров свечение фотофоров обусловлено наличием симбиотич. светящихся бактерий, причём каждому виду организмов соответствует определённый вид бактерий.Биологическая роль
Большинство способных к Б. организмов генерируют световые вспышки длительностью 0,1-1 с в ответ на внешние, преим. механические, стимулы. Чаще всего такие вспышки отпугивают, дезориентируют или ослепляют потенциальных врагов. У некоторых организмов (колониальные оболочники рода Pyrosoma, эувфазиевые раки рода Meganyctiphanes и др.) вспышки Б. являются сигналом коллективной опасности для особей своего вида, у светляков - для привлечения особей др. пола. Длительность вспышек и интервалы между ними у самок некоторых светляков видоспецифичны, что позволяет им в местах, где обитает много др. видов светляков, находить самцов своего вида. У многоклеточных животных световые вспышки контролируются нервной системой и обычно скоординированы с двигательными защитными реакциями. Сравнительно немногие организмы - бактерии, грибы, отд. виды олигохет, многоножек, насекомых и др. - светятся непрерывно (статическая Б.). Такое свечение используется гл. обр. для привлечения др. организмов. Так, паразитич. фотобактерии светом своих колоний (в хозяине, его трупе, помёте) привлекают новых хозяев - рыб или ракообразных. Некоторые агариковые грибы (напр., Panelus stipticus) завлекают светом своих плодовых тел насекомых - распространителей их спор. Хищные рыбы удильщики приманивают свою жертву к светящемуся кончику «удилища» - выступающего над нижней челюстью отростка. Личинки новозеландских комаров заманивают других, более мелких насекомых в подсвеченную телом ловчую сеть, а полихеты Odontosyllis привлекают светом особей др. пола. Глубоководные рыбы Malacosteus niger освещают ближнее пространство красным светом, который не видят др. глубоководные животные; рыбы Leognathus подсвечивают брюшко для маскировки на светлом фоне водной поверхности и т. д.Разнообразие типов биолюминесценции
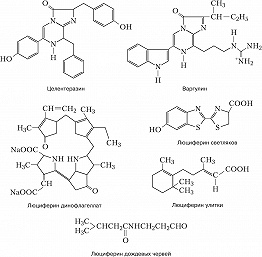
Субстраты и тем более ферменты реакций, сопровождающихся свечением, существенно различаются даже у близкородственных видов (напр., среди веслоногих и ракушковых рачков). Описано более 30 типов Б., которые возникли в ходе эволюции независимо друг от друга. Но иногда одинаковые люциферины обнаруживаются у неродственных организмов (напр., целентеразин радиолярий, кишечнополостных, гребневиков, ракообразных; варгулин ракушковых ракообразных и питающихся ими рыб), что, вероятно, является следствием определённых пищевых связей или горизонтального переноса генов. У некоторых планктонных рачков, моллюсков и др. животных люциферин и люцифераза выделяются во внешнюю среду, где смешиваются и в присутствии кислорода светятся либо в составе слизи, покрывающей тело животного, либо в виде расплывающегося в воде светового облака. У агариковых грибов свечение сопровождает неферментативное окисление люциферина (производное пенальдегида) супероксид анион-радикалом. Но чаще Б. появляется в результате внутриклеточных ферментативных реакций. У многощетинковых червей из сем. Polynoidae свечение выростов на спинной стороне члеников обусловлено окислением супероксидом люциферин-люциферазного комплекса - полиноидина, причём вспышки генерируются при нервном возбуждении фотоцитов. У американских дождевых червей Diplocardia longa яркое свечение сопровождает катализируемое люциферазой (пероксидазой) окисление N-изовалерил-3-аминопропеналя пероксидом водорода. У некоторых динофлагеллат люциферин исходно соединён с особым люциферин-связывающим белком; раздражение клетки вызывает подкисление цитоплазмы, при котором люциферин отделяется от этого белка и окисляется при участии люциферазы молекулярным кислородом. У радиолярий, гидроидных полипов и гребневиков Са 2+ - связывающий белок (фотопротеин) катализирует окисление присоединённого к нему люциферина (целентеразина) кислородом с образованием гидропероксида, последующий распад которого (в момент присоединения Са 2+ к этому белку) сопровождается свечением. У фотобактерий статическая Б. вызвана ферментативным окислением флавиннуклеотида - кофактора одного из дыхательных ферментов; в реакции участвует миристиновый альдегид. У светляков люцифераза катализирует реакцию окисления производного бензотиазола молекулярным кислородом после присоединения к этой молекуле аденозинмонофосфата в результате реакции с аденозинтрифосфатом. Существует предположение, что исходно разнотипные люциферины выполняли функцию антиоксидантов и защищали организм от активных форм кислорода, образующихся в качестве побочных продуктов аэробного дыхания или специально генерируемых для уничтожения фагоцитами микробных клеток, в качестве сигналов, управляющих некоторыми внутриклеточными процессами, и т. д. Практическое значение. Измерение интенсивности Б. широко применяется в науч. исследованиях и практике. Снижение Б. фотобактерий при действии неблагоприятных факторов окружающей среды позволяет использовать их в экологич. мониторинге (напр., в качестве показателя экологич. «здоровья» моря) и токсикологич. анализе. При лабораторном клинич. анализе измерение интенсивности бактериальной Б. делает возможным определение концентрации альдегидов, НАД · Н (восстановленная форма никотинамиддинуклеотида), флавиновых нуклеотидов, а также активности ряда окислительно-восстановит. ферментов. Препарат, содержащий смесь люциферина и люциферазы светляка, - самый чувствительный из существующих индикаторов для определения концентрации АТФ в биологич. средах. Люциферины целентеразин и варгулин используют для обнаружения супероксид анион-радикалов. Ca 2 + -активируемые фотопротеины гидромедузы Aequorea victoria и гидроидов Obelia longissima (соответственно экворин и обелин) используют в качестве сверхчувствительных индикаторов Ca 2 + в живых клетках. С их помощью, напр., удалось изучить роль Ca 2 + в управлении внутриклеточными процессами: мышечном сокращении, нейросинаптич. передаче, оплодотворении яйцеклетки и др. Т. н. зелёный флуоресцирующий белок (GFP), преобразующий синий свет люминесценции в зелёный у некоторых кишечнополостных (в т. ч. гидромедузы A. victoria), применяют в генетич. инженерии. Соединяя ген GFP с генами др. белков, можно следить за синтезом последних во флуоресцентном микроскопе. Кроме того, белком GFP метят разл. клетки (в т. ч. бактериальные) для наблюдения за их размножением. В качестве генетич. метки широко используются разноцветные варианты белков GFP-типа, ответственные за цветную флуоресценцию и окраску небиолюминесцентных морских животных.Литература Лит.: Владимиров Ю.А. Сверхслабые свечения при биохимических реакциях. М., 1966; Владимиров Ю. А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М., 1989; Бровко Л. Ю., Угарова Н.Н. Тайны и загадки «живого» света // Природа. 1998. № 2; Лабас Ю. А., Гордеева А.В. Неразгаданная Дарвином биолюминесценция // Там же. 2003. № 2; Лабас Ю. А., Гордеева А. В., Фрадков А.Ф. Флуоресцирующие и цветные белки // Там же. 2003. № 3; Hastings J. W., Johnson С. H. Bioluminescence and chemiluminescence // Biophotonics. Pt. B. Methods in Enzymology. 2003. Vol. 360.


