Автор: Родионов И.Л.
Статей: 1Аминокислоты
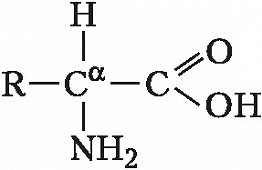
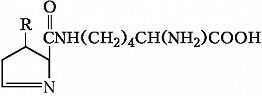
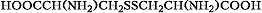
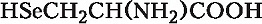
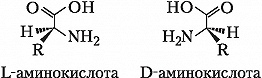
Пирролизин (где R=CH3, NH2 или OH)
Цистин
Селеноцистеин
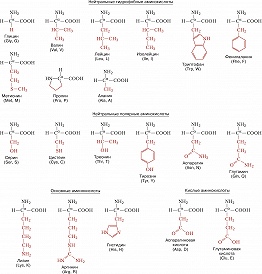
Таблица. Важнейшие аминокислоты, входящие в состав белков
АМИНОКИСЛОТЫ
Авторы: В.М. Липкин, И.Л. РодионовАМИНОКИСЛОТЫ, органич. соединения, содержащие карбоксильные COOH и аминогруппы NH 2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α -, β -, γ - и др. А. У ω -А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация
Описано свыше 150 природных А., среди которых особенно важны 20 α -А. (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула: В зависимости от природы боковой цепи R α -А. подразделяют на две группы: А. с неполярными (гидрофобными) и А. с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью - аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической - фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β - и γ -карбоксильные группы при рН 7,0 заряжены отрицательно. К основным А. относятся лизин, аргинин и гистидин. ε - Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина - в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α -А. - селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин - триплетом UGA, а пирролизин - UAG. Большая часть А., обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5- гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин - десмозин. Помимо α -А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α -углеродным атомом. К их числу относятся β -аланин, входящий в состав пантотеновой кислоты, γ -аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ -аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.Физические и химические свойства
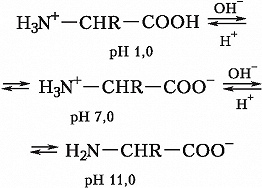
А. - бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220- 315 °C. В кристаллах и водных растворах при нейтральных значениях рН α -А. существуют преим. в виде диполярных ионов (цвиттер- ионов), у которых аминогруппы протонированы, а карбоксильные группы диссоциированы (СОО -). А. являются амфолитами; ионизация их молекул зависит от рН раствора: Значения pH, при котором концентрация катионов А. равна концентрации анионов, называется изоэлектрической точкой (p I). Аминогруппа А. ионизирована в неск. меньшей степени, чем карбоксильная группа, поэтому водный раствор А. имеет слабокислый характер. Все α -А., кроме глицина, имеют асимметрический (хиральный) α -углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β -углеродные атомы. За редким исключением природные α -А. относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D- ряда. В результате взаимодействия α -аминогруппы одной А. с α -карбоксильной группой другой А. в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.Превращения аминокислот в организмах
Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот - продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство А. из обычных безазотистых продуктов обмена и аммониевого азота. Это т. н. заменимые А. Но ряд А. - незаменимых - они должны получать в готовом виде с пищей. Для человека, напр., незаменимыми А. являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот - промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО 2 и Н 2 О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин - дофамина и адреналина, триптофан - серотонина, гистидин - гистамина, глутаминовая кислота - γ -аминомасляной кислоты, аргинин - оксида азота (NO).Практическое использование
Смеси L- α -А., а также отдельные А. применяют в медицине для лечения больных с заболеваниями пищеварит. органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психич. заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ - аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой пром-сти - глутамат натрия и лизин. ω -А. и их лактамы служат для боковые цепи) пром. произ-ва полиамидов. Ароматич. А. нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L- α -А. получают микробиологич. синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).Литература Лит.: Гринштейн Дж., Виниц М. Химия аминокислот и пептидов. М., 1965; Meister A. Biochemistry of the amino acids. 2nd ed. N. Y., 1965. Vol. 2; Chemistry and biochemistry of the amino acids. L., 1984; Cohn W. E. Nomenclature and symbolism of α -amino acids // Methods Enzymology. 1984. Vol. 106. № 3; Amino acids and peptides. L., 1985; IUPAC-IUB. Joint commission on biochemical nomenclature. Amino acids section. www.chem.qmul.ac.uk/iupac/AminoAcid/


