Автор: Щелкунов С.Н.
Статей: 3Генетическая инженерия
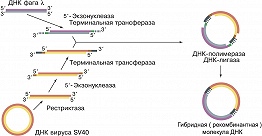
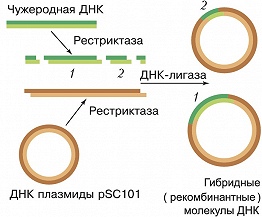
Рис. 1. Схема, иллюстрирующая получение первой рекомбинантной ДНК П. Бергом. Кольцевую ДНК обезьяньего вируса SV40 переводили в линейную форму, разрывая её рестриктазой. Для облегчения встраивания в н...
Рис. 2. Схема получения рекомбинантных ДНК по С. Коэну. ДНК плазмиды расщепляли с помощью рестриктазы, которая образует выступающие одноцепочечные взаимокомплементарные (липкие) концы. Эту ДНК смешива...
ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
Авторы: С.Н. ЩелкуновГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ, совокупность методов биохимии и молекулярной генетики, с помощью которых осуществляется направленное комбинирование генетич. информации любых организмов. Г. и. позволяет преодолевать природные межвидовые барьеры, препятствующие обмену генетич. информацией между таксономически удалёнными видами организмов, и создавать клетки и организмы с не существующими в природе сочетаниями генов, с заданными наследуемыми свойствами. Гл. объектом генно-инженерного воздействия является носитель генетич. информации - дезоксирибонуклеиновая кислота (ДНК), молекула которой обычно состоит из двух цепей. Строгая специфичность спаривания пуриновых и пиримидиновых оснований обусловливает свойство комплементарности - взаимного соответствия нуклеотидов в двух цепях. Создание новых сочетаний генов оказалось возможным благодаря принципиальному сходству строения молекул ДНК у всех видов организмов, а фактич. универсальность генетич. кода обеспечивает экспрессию чужеродных генов (проявление их функциональной активности) в любых видах клеток. Этому способствовало также накопление знаний в области химии нуклеиновых кислот, выявление молекулярных особенностей организации и функционирования генов (в т. ч. установление механизмов регуляции их экспрессии и возможности подчинения генов действию «чужих» регуляторных элементов), разработка методов секвенирования ДНК, открытие полимеразной цепной реакции, позволившей быстро синтезировать любой фрагмент ДНК. Важными предпосылками для появления Г. и. явились: открытие плазмид, способных к автономной репликации и переходу из одной бактериальной клетки в другую, и явления трансдукции - переноса некоторых генов бактериофагами, что позволило сформулировать представление о векторах: молекулах - переносчиках генов. Огромное значение в развитии методологии Г. и. сыграли ферменты, участвующие в преобразовании Рис. 1. Схема, иллюстрирующая получение первой рекомбинантной ДНК П. Бергом. Кольцевую ДНК обезьяньего вируса SV40 переводили в линейную форму, разрывая её рестриктазой. Для облегчения встраивания в н... нуклеиновых кислот: рестриктазы (узнают в молекулах ДНК строго определённые последовательности - сайты - и «разрезают» двойную цепь в этих местах), ДНК- лигазы (ковалентно связывают отд. фрагменты ДНК), обратная транскриптаза (синтезирует на матрице РНК комплементарную копию ДНК, или кДНК) и др. Только при их наличии создание искусств. структур стало технически выполнимой задачей. Ферменты используются для получения индивидуальных фрагментов ДНК (генов) и создания молекулярных гибридов - рекомбинантных ДНК (рекДНК) на основе ДНК плазмид и вирусов. Последние доставляют нужный ген в клетку хозяина, обеспечивая там его размножение (клонирование) и образование конечного продукта гена (его экспрессию).
Принципы создания рекомбинантных молекул ДНК
Термин «Г. и.» получил распространение после того, как в 1972 П. Бергом с сотрудниками впервые была получена рекомбинантная ДНК, представлявшая собой гибрид, в котором были соединены фрагменты ДНК бактерии кишечной палочки, её вируса (бактериофага λ) и ДНК обезьяньего вируса SV40 (рис. 1). В 1973 С. Коэн с сотрудниками использовали плазмиду pSC101 и рестриктазу (Eco RI), которая разрывает её в одном месте таким образом, что на концах двухцепочечной молекулы ДНК образуются короткие комплементарные одноцепочечные «хвосты» (обычно 4-6 нуклеотидов). Их назвали «липкими», поскольку они могут спариваться (как бы слипаться) друг с другом. Когда такую ДНК смешивали с фрагментами чужеродной ДНК, обработанной той же рестриктазой и имеющей такие же липкие концы, получались новые гибридные плазмиды, каждая из которых содержала, по крайней мере, один фрагмент чужеродной ДНК, встроенной в Eco RI-сайт плазмиды (рис. 2). Стало очевидным, что в такие плазмиды можно встраивать фрагменты разнообразных чужеродных ДНК, полученных как из микроорганизмов, так и из высших эукариот. Осн. совр. стратегия получения рекДНК сводится к следующему: 1) в ДНК плазмиды или вируса, способных размножаться независимо от хромосомы, встраивают принадлежащие др. организму фрагменты ДНК, содержащие определённые гены или искусственно полученные последовательности нуклеотидов, представляющие интерес для исследователя; 2) образующиеся при этом гибридные молекулы вводят в чувствительные прокариотич. или эукариотич. клетки, где они реплицируются (размножаются, амплифицируются) вместе со встроенными в них фрагментами ДНК; 3) отбирают клоны клеток в виде колоний на спец. питательных средах (или вирусов в виде зон просветления - бляшек на слое сплошного роста клеток бактерий или культур тканей животных), содержащие нужные типы молекул рекДНК и подвергают их разностороннему структурно-функциональному изучению. Для облегчения отбора клеток, в которых присутствует рекДНК, используют векторы, содержащие один и более маркеров. У плазмид, напр., такими маркерами могут служить гены устойчивости к антибиотикам (отбор клеток, содержащих рекДНК, проводят по их способности расти в присутствии того или иного антибиотика). РекДНК, несущие нужные гены, отбирают и вводят в реципиентные клетки. С этого момента начинается молекулярное клонирование - получение копий рекДНК, а следовательно, и копий целевых генов в её составе. Только при возможности разделения всех трансфицированных или инфицированных клеток каждый клон будет представлен отд. колонией клеток и содержать определённую рекДНК. На заключит. этапе производится идентификация (поиск) клонов, в которых заключён нужный ген. Она основывается на том, что вставка в рекДНК детерминирует какое-то уникальное свойство содержащей его клетки (напр., продукт экспрессии встроенного гена). В опытах по молекулярному клонированию соблюдаются 2 осн. принципа: ни одна из клеток, где происходит клонирование рекДНК, не должна получить более одной плазмидной молекулы или вирусной частицы; последние должны быть способны к репликации. В качестве векторных молекул в Г. и. используется широкий спектр плазмидных и вирусных ДНК. Наиболее популярны клонирующие векторы, содержащие неск. генетич. маркеров и имеющие по одному месту действия для разных рестриктаз. Таким требованиям, напр., лучше всего отвечает плазмида pBR322, которая была сконструирована из исходно существующей в природе плазмиды с помощью методов, применяемых при работе с рекДНК; она содержит гены устойчивости к ампициллину и тетрациклину, а также по одному сайту узнавания для 19 разных рестриктаз. Частным случаем клонирующих векторов являются экспрессирующие векторы, которые наряду с амплификацией обеспечивают правильную и эффективную экспрессию чужеродных генов в реципиентных клетках. В ряде случаев молекулярные векторы могут обеспечивать интеграцию чужеродной ДНК в геном клетки или вируса (их называют интегративными векторами). Одна из важнейших задач Г. и. - создание штаммов бактерий или дрожжей, линий клеток тканей животных или растений, а также трансгенных растений и животных (см. Трансгенные организмы), которые обеспечивали бы эффективную экспрессию клонируемых в них генов. Высокий уровень продукции белков достигается в том случае, если гены клонируются в многокопийных векторах, т. к. при этом целевой ген будет находиться в клетке в большом количестве. Важно, чтобы кодирующая последовательность ДНК находилась под контролем промотора, который эффективно узнаётся РНК-полимеразой клетки, а образующаяся мРНК была бы относительно стабильной и эффективно транслировалась. Кроме того, чужеродный белок, синтезируемый в реципиентных клетках, не должен подвергаться быстрой деградации внутриклеточными протеазами. При создании трансгенных животных и растений часто добиваются тканеспецифичной экспрессии вводимых целевых генов. Поскольку генетич. код универсален, возможность экспрессии гена определяется лишь наличием в его составе сигналов инициации и терминации транскрипции и трансляции, правильно узнаваемых хозяйской клеткой. Т. к. большинство генов высших эукариот имеет прерывистую экзон-интронную структуру, в результате транскрипции таких генов образуется матричная РНК-предшественник (пре-мРНК), из которой при последующем сплайсинге выщепляются некодирующие последовательности - интроны и образуется зрелая мРНК. Такие гены не могут экспрессироваться в клетках бактерий, где отсутствует система сплайсинга. Для того чтобы преодолеть это препятствие, на молекулах зрелой мРНК с помощью обратной транскриптазы синтезируют ДНК-копию (кДНК), к которой с помощью ДНК- полимеразы достраивается вторая цепь. Такие фрагменты ДНК, соответствующие кодирующей последовательности генов (уже не разделённой интронами), можно встраивать в подходящий молекулярный вектор. Зная аминокислотную последовательность целевого полипептида, можно синтезировать кодирующую его нуклеотидную последовательность, получив т. н. ген- эквивалент, и встроить его в соответствующий экспрессирующий вектор. При создании гена-эквивалента обычно учитывают свойство вырожденности генетич. кода (20 аминокислот кодируются 61 кодоном) и частоту встречаемости кодонов для каждой аминокислоты в тех клетках, в которые планируется вводить этот ген, т. к. состав кодонов может существенно отличаться у разных организмов. Правильно подобранные кодоны могут значительно повысить продукцию целевого белка в реципиентной клетке.Значение генетической инженерии
Г. и. значительно расширила эксперим. границы молекулярной биологии, поскольку стало возможным вводить в разл. типы клеток чужеродную ДНК и исследовать её функции. Это позволило выявлять общебиологич. закономерности организации и выражения генетич. информации в разл. организмах. Данный подход открыл перспективы создания принципиально новых микробиологич. продуцентов биологически активных веществ, а также животных и растений, несущих функционально активные чужеродные гены. Мн. ранее недоступные биологически активные белки человека, в т. ч. интерфероны, интерлейкины, пептидные гормоны, факторы крови, стали нарабатываться в больших количествах в клетках бактерий, дрожжей или млекопитающих и широко использоваться в медицине. Более того, появилась возможность искусственно создавать гены, кодирующие химерные полипептиды, обладающие свойствами двух или более природных белков. Всё это дало мощный импульс к развитию биотехнологии. Главными объектами Г. и. являются бактерии Escherichia coli (кишечная палочка) и Bacillus subtilis (сенная палочка), пекарские дрожжи Saccharomices cerevisiae, разл. линии клеток млекопитающих. Спектр объектов генно-инженерного воздействия постоянно расширяется. Интенсивно развиваются направления исследований по созданию трансгенных растений и животных. Методами Г. и. создаются новейшие поколения вакцин против разл. инфекц. агентов (первая из них была создана на основе дрожжей, продуцирующих поверхностный белок вируса гепатита В человека). Большое внимание уделяется разработке клонирующих векторов на основе вирусов млекопитающих и использованию их для создания живых поливалентных вакцин для нужд ветеринарии и медицины, а также в качестве молекулярных векторов для генной терапии раковых опухолей и наследств. заболеваний. Разработан метод прямого введения в организм человека и животных рекДНК, направляющих продукцию в их клетках антигенов разл. инфекц. агентов (ДНК-вакцинация). Новейшим направлением Г. и. является создание съедобных вакцин на основе трансгенных растений, таких как томаты, морковь, картофель, кукуруза, салат и др., продуцирующих иммуногенные белки возбудителей инфекций.Опасения, связанные с проведением генно-инженерных экспериментов
Вскоре после первых успешных экспериментов по получению рекДНК группа учёных во главе с П. Бергом предложила ограничить проведение ряда генно-инженерных опытов. Эти опасения основывались на том, что свойства организмов, содержащих чужую генетич. информацию, трудно предсказать. Они могут приобрести нежелательные признаки, нарушить экологич. равновесие, привести к возникновению и распространению необычных заболеваний человека, животных, растений. Кроме того, отмечалось, что вмешательство человека в генетич. аппарат живых организмов аморально и может вызвать нежелательные социальные и этич. последствия. В 1975 эти проблемы обсуждались на междунар. конференции в Асиломаре (США). Её участники пришли к заключению о необходимости продолжения использования методов Г. и., но при обязательном соблюдении определённых правил и рекомендаций. Впоследствии эти правила, установленные в ряде стран, были существенно смягчены и свелись к приёмам, обычным в микробиологич. исследованиях, созданию спец. защитных устройств, препятствующих распространению биологич. агентов в окружающей среде, использованию безопасных векторов и реципиентных клеток, не размножающихся в природных условиях. Часто под Г. и. понимают только работу с рекДНК, а как синонимы Г. и. используются термины «молекулярное клонирование», «клонирование ДНК», «клонирование генов». Однако все эти понятия отражают содержание лишь отд. генно-инженерных операций и поэтому не эквивалентны термину «Г. и.». В России как синоним Г. и. широко используется термин «генная инженерия». Однако смысловое содержание этих терминов различно: Г. и. ставит целью создание организмов с новой генетич. программой, в то время как термин «генная инженерия» поясняет, как это делается - путём манипуляции с генами.Литература Лит.: Щелкунов С.Н. Клонирование генов. Новосиб., 1986; он же. Генетическая инженерия. 2-е изд., Новосиб., 2004; Уотсон Дж., Туз Дж., Курц Д. Рекомбинантные ДНК. М., 1986; Клонирование ДНК. Методы. М., 1988; Новое в клонировании ДНК: Методы. М., 1989.
Оспы натуральной вирус
ОСПЫ НАТУРАЛЬНОЙ ВИРУС
Авторы: С.Н. ЩелкуновОСПЫ НАТУРАЛЬНОЙ ВИРУС (вирус оспы), вирус рода Orthopoxvirus сем. посквирусы (Poxviridae), возбудитель оспы натуральной. Относится к строго антропонозным вирусам - поражает только человека. После глобальной ликвидации натуральной оспы штаммы этого вируса находятся только в коллекциях двух сотрудничающих центров ВОЗ: ГНЦ вирусологии и биотехнологии «Вектор» (пос. Кольцово, Новосибирская обл., Россия) и Центра по контролю и профилактике заболеваний (г. Атланта, штат Джорджия, США). Вирусная частица 250-300 Ч 200 Ч 250 нм (одна из самых крупных среди вирусов млекопитающих, может быть обнаружена с помощью оптич. микроскопии) имеет форму кирпича с закруглёнными углами. Геном представлен линейной двунитевой молекулой ДНК; содержит 186-187 тыс. пар нуклеотидов. Вирусы устойчивы к высушиванию и низким температурам, моментально погибают при 100 °С. На основе данных филогенетич. анализа последовательностей в вирусной ДНК и датирования завоза оспы на Амер. континент вычислено, что О. н. в. произошёл от зоонозного ортопоксвируса с широким кругом хозяев ок. 3400 ± 800 лет назад предположительно на территории Индостана. Геном вируса оспы содержит многочисл. гены, кодирующие белки-иммуномодуляторы, эволюционно адаптированные к защитным системам организма человека. На основе этих белков возможно создание терапевтич. препаратов новейшего поколения для антицитокиновой терапии, в т. ч. ревматоидного артрита и септич. шока.
Поксвирусы
ПОКСВИРУСЫ
Авторы: С.Н. ЩелкуновПОКСВИРУСЫ (Poxviridae, от англ. рох - кожная сыпь и вирусы), семейство самых крупных ДНК-содержащих вирусов позвоночных (подсемейство Chordopoxvirinae) и насекомых (подсемейство Entomopoxvirinae). Подсемейство вирусов позвоночных включает 8 родов, представители четырёх из них (Orthopoxvirus, Parapoxvirus, Molluscipoxvirus и Yatapoxvirus) патогенны для человека. Вирионы П. (размер 220- 450 Ч 140-260 Ч Ч 140-260 нм, после окрашивания их можно увидеть с помощью светового микроскопа) имеют вид кирпича или овальную форму. Представлены геномом (линейной двухцепочечной молекулой ДНК, содержащей 130-375 тыс. пар нуклеотидов, на обоих концах которой имеются ковалентные сшивки - шпильки) и множеством структурных белков, а также синтезируемых вирусом ферментов, необходимых для репликации вирусной ДНК и её транскрипции, процессинга вирусных мРНК, модификации белков; они заключены в две (внутриклеточные вирионы) или в три (внеклеточные вирионы) липопротеиновые оболочки. Весь цикл развития П. проходит в цитоплазме клетки в дискретных структурах, окружённых мембранами эндоплазматич. ретикулума. Инфекции, вызываемые П. у животных и человека, нередко сопровождаются везикулярно-пустулёзной сыпью. К П. относится оспы натуральной вирус.


